Reconocimiento de grupos funcionales
logros:
Observar algunas propiedades físicas y químicas de compuestos orgánicos reconocer experimentalmente aldehidos, cetonas,hidrocarburos,alcoholes,ácidos carboxilicos,urea,lactosa y glucosa.
Reactivos
Agua
urea
Sal organica
Sacarosa
Lactosa
Naftalina
Amoniaco
Acetato de plomo
Azucar
Acido benzoico
Fructosa
Acido Citrico
Materiales
Tubo de ensayo
Candela
Recipiente
Prueba de Lucas
La prueba de Lucas, en los alcoholes es un ensayo químico para diferenciar entre alcoholes primarios, secundarios y terciarios. Se basa en la diferencia en reactividad de los tres tipos de alcoholes con halogenuros dehidrógeno.
Cuando se agrega el reactivo de Lucas (ZnCl2 en solución de HCl concentrado) al alcohol, H+ del HCl protonará elgrupo -OH del alcohol, tal que el grupo saliente H2O, siendo un nucleófilo más débil que el OH-, pueda sersustituido por el nucleófilo Cl-. El reactivo de Lucas ofrece un medio polar en el que el mecanismo SN1 estáfavorecido. En la sustitución nucleofílica unimolecular, la velocidad de reacción es más rápida cuando elcarbocatión intermediario está más estabilizado por un mayor número de grupos alquilo (R-) donantes deelectrones, unidos al átomo de carbono cargado positivamente. Los alcoholes terciarios reaccionaninmediatamente con el reactivo de Lucas para producir turbidez, mientras que los alcoholes secundarios lo hacenen cinco minutos. Los alcoholes primarios no reaccionan significativamente con el reactivo de Lucas a temperaturaambiente.
El reactivo disuelve al alcohol, eliminando el grupo OH, formando un carbocatión. La velocidad de esta reacción esproporcional a la energía requerida para formar el carbocatión, así que los carbocationes terciarios, bencílicos, alílicos reaccionan rápidamente, mientras que los alcoholes más pequeños, menos sustituidos, reaccionan máslentamente. La turbidez observada se debe al carbocatión que reacciona inmediatamente con el anión cloruro, creando un cloroalcano insoluble.
De ahí que, el tiempo que toma la turbidez en aparecer es una medida de la reactividad del tipo de alcohol con elreactivo de Lucas, y esto es utilizado para diferenciar entre las tres clases de alcoholes:
- no hay reacción visible: alcohol primario
- la solución se turbia en 3-5 minutos: alcohol secundario
- la solución se vuelve turbia inmediatamente, y/o las fases se separan: alcohol terciario, bencílico o alílico
Prueba de Baeyer
La prueba de Baeyer consiste en adicionar una solución alcalina de KMnO4 a una muestra donde se cree existen insaturaciones, de haberla el color morado de la solución desaparece, debido a que el permanganato ha oxidado las dobles ligaduras y el se ha reducido a dioxido de manganeso.
Clasificación de los azucares
Los azúcares se clasifican según el número de unidades de los que están formados:
Monosacáridos
Formados solo por una unidad, también se llaman azúcares simples. Los más presentes en la naturaleza son los siguientes:
Disacáridos
Formados por dos monosacáridos, iguales o diferentes, también se llaman azúcares dobles. Los más presentes en la naturaleza son los siguientes:
Trisacáridos
Formados por tres monosacáridos, iguales o diferentes, también se llaman azúcares triples. Los más presentes en la naturaleza son los siguientes:
- Maltotriosa
- Rafinosa
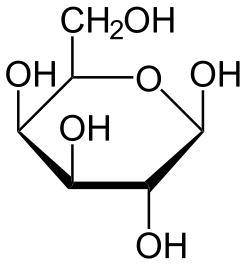
5 azúcares con formula estructural
Sacarosa Fructosa


Glucosa

Lactosa Galactosa

Reactivo de Fehling
El reactivo de Fehling, también conocido como Licor de Fehling, es una disolución descubierta por el químico alemán Hermann von Fehling y que se utiliza como reactivo para la determinación de azúcares reductores.
El reactivo de Fehling, también conocido como Licor de Fehling, es una disolución descubierta por el químico alemán Hermann von Fehling y que se utiliza como reactivo para la determinación de azúcares reductores.
Sirve para demostrar la presencia de glusosa, así como para detectar derivados de ésta tales como la sacarosa o la fructosa. El licor de Fehling consiste en dos soluciones acuosas:
- Sulfato de cobre cristalizado, 35 g y agua destilad hasta 1.000 mL.
- Sal de Seignette o Tartrato mixto de potasio y sodio 150 g, solución de hidróxido de sodio al 40 %, 3 g y agua hasta 1.000 mL.
Ambas se guardan separadas hasta el momento de su uso, para evitar la precipitación del hidróxido de cobre.
El ensayo con el licor de Fehling se fundamenta en el poder reductor del grupo carbonilo de los aldehídos. Éste se oxida a ácido y reduce la sal de cobre en medio alcalino a óxido de cobre, formando un precipitado de color rojo.
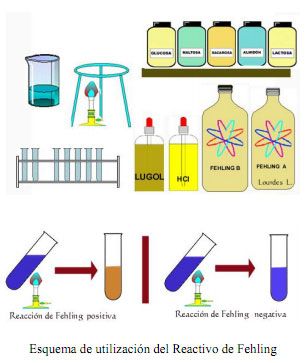
Un aspecto importante de esta reacción es que la forma aldehído puede detectarse fácilmente aunque exista en muy pequeña cantidad. Si un azúcar reduce el licor de Fehling a óxido de cobre rojo, se dice que es un azúcar reductor.
Esta reacción se produce en medio alcalino fuerte, por lo que algunos compuestos no reductores como la fructosa que contiene un grupo cetona, puede enolizarse a la forma aldehido dando lugar a un falso positivo. Al reaccionar con monosacaridos se torna verdoso, y si lo hace con disacáricos toma el color del ladrillo.
Por ebullición se decolora el reactivo. Un cc. de reactividad corresponde a 0’005 gr. de glucosa. Sensibilidad 1:500.
No hay comentarios:
Publicar un comentario